Controle de Qualidade Plaquetas – Entendendo os Riscos do Processamento – PARTE 2: PROCESSAMENTO
 Após a coleta, as bolsas de sangue total devem permanecer em repouso em temperatura de 20-24°C por duas horas antes de serem processadas. Conforme o artigo 39 da RDC 34/2014, idealmente o tempo de repouso para produção das plaquetas é de até 8 horas, não excedendo 24 horas¹:
Após a coleta, as bolsas de sangue total devem permanecer em repouso em temperatura de 20-24°C por duas horas antes de serem processadas. Conforme o artigo 39 da RDC 34/2014, idealmente o tempo de repouso para produção das plaquetas é de até 8 horas, não excedendo 24 horas¹:
“Art. 39. Após a coleta, o sangue total deve ser estocado em temperatura entre 2° e 6° C, exceto quando destinado à preparação de concentrado de plaquetas, devendo, neste caso, ser mantido entre 20° e 24°C até o momento da separação das plaquetas, observado preferencialmente o tempo máximo de 8 (oito) horas, não excedendo 24 (vinte e quatro) horas, contadas a partir do fim da coleta.”
É importante salientar que apesar de todos os componentes de preservação contidos na bolsa, o fator tempo é crítico para a produção dos demais componentes no ciclo do sangue, excedê-lo implica na perda do produto. Segundo o Manual para Controle de Qualidade do Sangue Total e Hemocomponentes²:
“Após 24 horas do armazenamento do sangue total, microagregados podem se formar, há uma queda dos níveis de Fator VIII, aumento dos níveis de potássio e as plaquetas e os granulócitos perdem a viabilidade.”
Após descanso, as bolsas devem ser arrumadas com cuidado dentro dos suportes da centrifugadora para que durante o processo de centrifugação os filtros e demais bolsas conectadas à principal não saiam dos suportes e se quebrem, ou rasguem, lançando o conteúdo da bolsa na centrifugadora. Considerar o peso de cada bolsa colocada também é importante, pois evita danos à máquina, e evita que o desbalanço durante a centrifugação afete o resultado final.
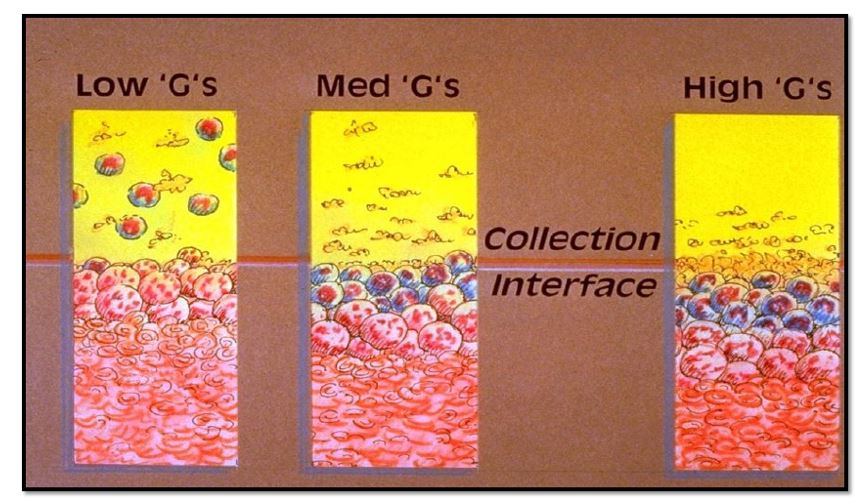
A primeira centrifugação deve ser leve, suficiente para fracionar as hemácias no fundo da bolsa mas leve o bastante para manter os demais componentes suspensos no plasma. Uma rotação exagerada “esmaga” as plaquetas e leucócitos contra a camada de hemácias, afetando a qualidade final de ambos os produtos, pois são transferidas plaquetas em excesso para o concentrado de hemácias, e sobram poucas em suspensão no plasma para produção do concentrado de plaquetas.
(Aula “Produção x Controle” ministrada por Ricardo Omoto em 2012)
A rotação (g) de cada centro é determinada no processo de validação dos equipamentos com apoio dos fabricantes, pois a potência e raio de cada máquina interferem no cálculo. Usualmente a velocidade para centrifugação leve é de 2000 x g por 3 minutos, e para centrifugação pesada é de 5000 x g por 7 minutos.³
As bolsas são posicionadas em prensas manuais quando retiradas da centrífuga, e após a divisão do plasma e das hemácias em circuito fechado as bolsas devem ser seladas. O plasma resultante será inspecionado e se aprovado, a bolsa retornará para a centrífuga, onde será submetida a uma centrifugação pesada.
A inspeção do plasma consiste na avaliação visual se o mesmo está lipêmico (gordura em suspensão de aspecto leitoso), se tem alterações de cor, contaminação por hemácias, grumos e swirling.
No caso dos exemplos mostrados no fluxograma do processamento, as bolsas foram reprovadas, de cima para baixo, pelos seguintes motivos:
- GRUMOS. A presença de grumos pode ter diversas fontes, nesta etapa do processo pode ser causado por centrifugação com rotação ou tempo exagerados, temperatura inadequada na sala de processamento, e tempo de descanso insuficiente. Se os grumos aparecem após estocagem, podem estar relacionados a um desbalanço dos agitadores.² Conforme o Art. 108 da Portaria MS 158/2016, “unidades com agregados plaquetários grosseiramente visíveis não devem ser empregados na transfusão”4
- LIPEMIA. O plasma lipêmico tem aparência leitosa e vem do doador, que pode ter ingerido uma refeição pesada antes da doação, digestão insuficiente, medicamentos ou alguma doença que o doador tenha. A lipemia não impacta na qualidade do produto mas pode afetar na identificação de doenças infecciosas5, portanto, o plasma nesta condição é descartado;
- CONTAMINAÇÃO POR HEMÁCIAS. As causas podem ser várias, desde desbalanços na centrífuga, uma bolsa apertada no suporte e quando retirada houve agitação, e até mesmo um erro de atenção na transferência do plasma para a bolsa utilizando prensas manuais. A última não conformidade pode ser minimizada com o uso de prensas automáticas, que interrompem a pressão quando o laser identifica as hemácias na transferência;
- ALTERAÇÃO DE COR. As principais causas da coloração do plasma alterado são medicamentos e alguma doença que o doador tenha.
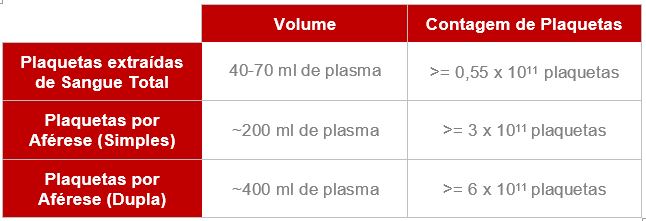
Nesta fase, o processamento de CP´s oriundos de aférese ou sangue total se unificam para contagem de plaquetas, leucócitos e demais processos.
Uma solução deve ser preparada manualmente, com uma parte de plaquetas para quatro partes do diluente, e uma analisador hematológico fará a contagem das plaquetas automaticamente colhendo uma gota desta solução. Após resultados, que levam aproximadamente 60 segundos, o colaborador fará o cálculo da quantidade de plaquetas totais que existem na bolsa considerando seu peso, e a forma de extração.
A contagem dos leucócitos pode ser feita manualmente em câmara de Nageotte ou processo automatizado. No processo manual, exige preparação de nova solução com amostra da bolsa imersa em nove partes de corante violeta, pipetamento na câmara de uma gota, descanso por 15 minutos, contagem em microscópio de quantos leucócitos podem ser visualizados em cada uma das 40 divisões da câmara, e por fim calcular os leucócitos residuais com auxílio de uma fórmula6. Por RDC 34/2014 uma bolsa deve ter contagem inferior a 5,0×106/unidade.
(A esquerda, uma câmara de Nageotte e suas divisões. A direta, uma visão em microscópio de uma das 40 divisões da câmara, onde o colaborador deve contar quantos leucócitos estão nela)
A desleucocitação do concentrado de plaquetas ocorre por meio de filtros nos tubos da própria bolsa de coleta. O processo de contagem manual tem alto risco de erros de processamento, além de ser trabalhoso, demorado, e inviável de ser incorporado em centros que processam grandes volumes de doações, uma vez que este teste precisa ser realizado em cada bolsa doada de plaquetas e hemácias. Para efeitos de comparação, um colaborador precisa de pelo menos 1 hora para fazer tudo, enquanto um analisador hematológico é capaz de fazer o mesmo trabalho em aproximadamente 5 minutos por bolsa com muito mais acurácia.
O concentrado de plaquetas deve ficar em agitação à temperatura ambiente por 24 horas dando tempo suficiente ao processamento, e á sorologia para realização dos testes. Em caso de sorologia alterada, a bolsa e demais hemocomponentes que possam estar em andamento devem ser retiradas do processamento e o processo de retrovigilância tem início, fazendo a convocação do doador, e se o mesmo era doador de repetição, fazendo o rastreio dos hemocomponentes doados por até 12 meses anteriores a esta conversão. O serviço de hemoterapia deve manter uma soroteca com amostras das bolsas transfundidas para futuras investigações, se necessário:
Art. 98. O serviço de hemoterapia deve manter plasmateca ou soroteca de cada doação, com as amostras devidamente identificadas e registradas e armazenadas em temperatura igual ou inferior a 20ºC negativos, por período mínimo de 6 (seis) meses.
(Art. 98 da RDC 34/2014)
Este tempo de 24 horas em descanso também é suficiente para permitir a proliferação bacteriana, caso tenha ocorrido.
Devido a temperatura de armazenagem ser de 20-24°C as plaquetas são alvo de contaminação microbiológica, pois são armazenadas a temperatura perfeita para proliferação. No passado, a RDC exigia que apenas 1% ou 10 unidades (o que fosse maior) da produção de plaquetas fosse testado, atualmente conforme Portaria MS 158/2016, seção V, artigo 116, o Brasil adere a normativa da AABB, e fica determinado que devido a esta condição, 100% dos concentrados plaquetários devem ser testados para contaminação microbiológica.
8º Pelo alto risco de contaminação microbiológica dos concentrados de plaquetas pela sua condição de armazenamento, recomenda-se realização de avaliação de contaminação microbiológica em 100% desta produção.
A análise microbiológica consiste na retirada de uma amostra da bolsa, em ambiente limpo antes de cada operação com solução degermante, e inocular esta amostra da bolsa em um solução propícia para bactérias aeróbicas e outra para bactérias anaeróbicas. Essas duas soluções serão adicionadas no equipamento Bact-Alert que fará a leitura dos resultados automaticamente, e informará caso algum resultado seja positivo.
As plaquetas agora deverão ser irradiadas para esterilização dos linfócitos T presentes no plasma, identificadas com o grupo sanguíneo ABO Rh, lote, e demais informações necessárias para localização e rastreio.
Teoricamente, apenas após 24 horas do inóculo da análise microbiológica seria possível disponibilizar a bolsa para uso. No entanto, vale lembrar que a validade das plaquetas é de apenas 5 dias após coleta, apenas as etapas de processamento e testes tomam 48 horas deste prazo, deixando apenas 72 horas possíveis para transfusão.
Outro aspecto importante a ser considerado, é a disponibilidade e a degradação natural do material. Ao longo desses cinco dias úteis, apesar de todos os esforços empregados tanto na estocagem como em aditivos na bolsa, as plaquetas naturalmente sofrem um processo de degradação diminuindo sua capacidade ativa conforme se aproxima do dia 5. O prazo e a dificuldade em conseguir doadores de plaquetas também tem sua parte nesse cenário, pois com certa frequência a única bolsa compatível com um paciente é exatamente aquela aprovada pela sorologia mas bloqueada pelo prazo de 24 horas de quarentena pós inóculo microbiológico.
Considerando todos estes fatores, algumas bolsas podem vir a ser liberadas antes do prazo de 24 horas pós inóculo. Contudo, essa liberação deve ser documentada e o médico responsável pelo paciente informado desta condição.
As bolsas de plaquetas devem ser armazenadas em agitadores, a temperatura de 20-24°C. As prateleiras desses agitadores devem ser em forma de grade, e não se pode empilhar bolsas umas sobre as outras. A qualidade da plaqueta depende de sua capacidade de fazer trocas gasosas com o ambiente, o que pode ser prejudicada pela prateleira do agitador, empilhamento e o material utilizado pelo fabricante de bolsas.²
*Letícia Farias Borges – Engenheira de Produção e pós graduada em Hemoterapia.
BIBLIOGRAFIA
1 – ANVISA. AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA. Resolução da diretoria colegiada- RDC nº 34, de 11 de Junho de 2014. Disponível em: http://portal.anvisa.gov.br/documents/10181/2867975/%281%29RDC_34_2014_COMP.pdf/ddd1d629-50a5-4c5b-a3e0-db9ab782f44a. Acessado em: 24/06/2020.
2 – REDSANG-SIBRATEC (2011). “Manual para Controle da Qualidade do Sangue Total e Hemocomponetes”. Retrieved from: http://redsang.ial.sp.gov.br/site/docs_leis/pd/pd1_manual_sangue.pdf
3 – MINISTÉRIO DA SAÚDE. Secretaria de Gestão do Trabalho e da Educação na Saúde Departamento de Gestão da Educação na Saúde (2013). “Técnico em Hemoterapia”
4 – BRASIL. Ministério da Saúde. Portaria n° 158, de 4 de Fevereiro de 2016.Redefine o regulamento técnico de procedimentos hemoterápicos. Retrieved from: https://bvsms.saude.gov.br/bvs/saudelegis/gm/2016/prt0158_04_02_2016.html
5 – Missisipi Valley Regional Blood Center. “Lipemia in Blood Products”. Retrieved from: https://www.bloodcenter.org/webres/File/hospitals/What%20is%20Lipemia%20in%20Blood%20Products.pdf
6 – CONTROL LAB (2007). “Contagem de Leucócitos Residuais pela Câmara de Nageotte”. Retrieved from: https://controllab.com/pdf/it_lab_077rev00_revisao.pdf